Процессы вакуумной дегазации и очистки тугоплавких металлов от газовых примесей
Процессы вакуумной дегазации и очистки тугоплавких металлов от растворимых газовых примесей
При взаимодействии тугоплавких металлов с газами происходит ряд физико-химических процессов: поверхностная физическая адсорбция газов, активированная адсорбция (хемосорбция), диффузия газов в металле и их абсорбция (растворение), химическое взаимодействие с образованием соединений. Доминирующая роль того или иного процесса зависит от природы металла и внешних условий (температуры, давления и др.).
В результате указанных процессов взаимодействия образуются поверхностные газовые адсорбционные и окисные пленки, а также происходит насыщение металлов газами и образование различных химических соединений (гидридов, нитридов и др.). Для удаления адсорбированных газов требуется специальная вакуумная дегазация, а также очистка тугоплавких металлов от растворенных (абсорбированных) газовых примесей.
Физическая адсорбция и десорбция газов
Поверхностная физическая адсорбция, или способность металлов удерживать на своей поверхности частицы газа, свойственна в одинаковой степени практически всем газам и зависит в основном не от свойств газа, а от состояния поверхности и природы металла (адсорбента). Поверхностная физическая адсорбция является первой стадией сорбционных процессов, происходящих при взаимодействии тугоплавких металлов с газами при низких температурах.
Тепловой эффект этого процесса невелик (на порядок меньше теплот образования химических соединений), поэтому считают, что физическая адсорбция обусловлена силами межмолекулярного взаимодействия, определяющую роль в которых играют силы Ван-дер-Ваальса.
С повышением давления количество адсорбированного газа возрастает до тех пор, пока на поверхности не образуется мономолекулярный его слой, после чего физическая адсорбция практически прекращается.
При постоянной температуре поверхность адсорбированного слоя определяется соотношением:
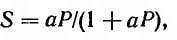
где 5 — поверхность, покрытая молекулами газа; а — константа; Р — давление газа.
С повышением температуры способность металлов к поверхностной адсорбции снижается и количество адсорбированных газов на поверхности уменьшается.
Процесс физической адсорбции является обратимым процессом, и при нагреве до определенных температур в вакууме можно практически полностью удалить адсорбированные на поверхности металла газы. Подробно вопросы дегазации и вакуумирования даны в [29].
Активированная адсорбция (хемосорбция) газов

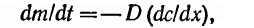
При взаимодействии с тугоплавкими металлами химически активных газов при повышении температуры физическая адсорбция постепенно переходит в активированную адсорбцию (хемосорбцию), при которой решающую роль играют силы химического взаимодействия. В отличие от физической адсорбции при активированной адсорбции молекулы газа диссоциируют на атомы, которые вступают в химическое взаимодействие с атомами металла на поверхности, насыщая незаполненные связи поверхностных атомов. Силы этого взаимодействия значительно превышают ван-дер-ваальсовы силы молекулярного взаимодействия, определяющие физическую адсорбцию. Поэтому теплота активированной адсорбции в несколько раз больше теплоты физической адсорбции и приближается к теплотам химических реакций. При диссоциации двухатомных молекул на атомы изотермы активированной адсорбции удовлетворительно описываются соотношением.
Процессы активированной адсорбции, как и физической, являются обратимыми, и путем вакуумирования при определенных температурах нагрева можно практически полностью удалить адсорбированные газы.
Абсорбция металлов и их дегазация
Помимо физической и активированной адсорбции газов, протекающих в поверхностных слоях металла при определенных температурных условиях, имеет место проникновение газов в более глубокие слои металла и его насыщение газом. В основе газонасыщения лежат диффузионные процессы, которые описываются известными законами Фика.
Согласно первому закону Фика, где dm — количество газа, продиффундировавшего за время t через единицу поверхности при градиенте концентрации dc/dty D — коэффициент диффузии.
Диффундирующий в металл газ распределяется среди металлических атомов, преимущественно в порах и в дефектных местах кристаллической решетки. Это явление удержания атомов газа в недрах кристаллической решетки металла в отличие от адсорбции их на поверхности называют абсорбцией.
Вследствие атомарного характера абсорбции на нее большое влияние оказывает активированная адсорбция, поскольку она определяет диссоциацию молекул на атомы, а следовательно, и диффузию газа в металлах. В этом отношении активированная адсорбция является своеобразной подготовительной стадией процесса диффузии газов в металлах. Установлено, что если возможна только физическая адсорбция какого-либо газа на поверхности металла, то такой газ не может диффундировать в металл. Например, инертные газы (гелий, аргон и др.) не хемосорбируют и не обладают способностью диффундировать в тугоплавкие металлы. Это объясняется тем, что в атомарном состоянии значительно облегчается перемещение газа в твердом металле.
Более того, в работе [30] было показано, что, например, водород ионизируется и диффундирует в металлах в виде протонов. Так как размеры протонов в сотни тысяч раз меньше размеров атомов, то скорость диффузии водорода в металлы чрезвычайно высока. По-видимому, исключение составляют металлы Via группы — молибден, вольфрам и хром, которые обладают слабым химическим сродством к водороду и не хемосорбируют его, а следовательно, и не ионизируют молекулы водорода. Поэтому водород обладает ничтожной растворимостью в указанных металлах — 0,00001% (по массе).
Количество газа, растворяющегося в металле, по данным работы [29], может быть определено из выражения:

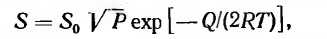
Скорость изменения концентрации газа в любой точке выражается вторым законом Фика, где So — постоянная, зависящая от системы газ — металл (определяется экспериментально); Р—-давление газа над металлом; Q — теплота растворения газа; R — газовая постоянная; Т — температура, К.
Проникновение растворенных газов во внутренние слои или обратный процесс —выход атомов примесных элементов к поверхности раздела определяется диффузионными характеристиками системы металл — газ, давлением газа над металлом и температурой.
Характер изменения растворимости газов в металлах в зависимости от температуры на примере адсорбции водорода ниобием, танталом и молибденом показан на изобарах растворимости, приведенных на рис. 16 [6].
Как следует из этих зависимостей, металлы V группы обладают большей способностью к поглощению газов по сравнению с металлами Via группы периодической системы элементов Д. И. Менделеева.
Для транспортировки атомов растворенных газов к поверхности металла в процессах дегазации большую роль играет скорость их диффузии, которой определяется время очистки металла от примесей. В настоящее время коэффициенты диффузии атмосферных газов (D, см2/с) в ряде тугоплавких металлов определены и по данным работы [31] описываются следующими соотношениями:

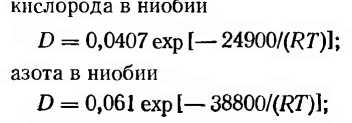
Таким образом, используя приведенные соотношения и законы диффузии, можно определить, при каких условиях следует ожидать очистки металлов от газовых примесей внедрения.