Взаимодействие с ванадием
Ванадий является одним из наиболее активных элементов V а группы и сильно взаимодействует с примесями внедрения.

Кислород с ванадием при малом его содержании образует твердый раствор внедрения, причем с понижением температуры растворимость кислорода в ванадии сильно уменьшается (рис. 8). При температуре перитектической реакции 1850° С растворимость составляет 5,0% (ат.), или 1,6% (по массе), при комнатной температуре— менее чем 0,8% (ат.), или 0,25% (по массе).
В равновесии с твердым раствором а находится окисная фаза 0 переменного состава, которая имеет о. ц. т. решетку с периодами: а=0,29 нм, с=0,35 нм, cfa= 1,180. Эта фаза соответствует составу VOo.ie— VO0,?3.
В связи с сильным изменением растворимости кислорода в ванадии при понижении температуры окисная фаза 0 выделяется из твердого раствора а в виде тонких окисных прослоек по границам зерен. При этом снижается пластичность ванадия и его способность к обработке давлением, а потому кислород следует считать вредной примесью в ванадии, и содержание кислорода не должно превышать предела его растворимости при комнатной температуре, т. е. менее 0,25% (по массе).
Азот с ванадием образует ограниченную область твердого раствора. Растворимость азота в ванадии при 1200° С составляет приблизительно 1,5, а при 800° С — 0,8% (по массе). При комнатной температуре его растворимость в ванадии не превышает 0,5% (по массе). Имеются указания [17], что ванадий с азотом образует два нитрида: V2N— с гексагональной решеткой с периодами: а=0,28 нм, с—0,45 нм, с/а= 1,601 и VN с кубической решеткой с периодом а=0,41 нм. Выделение этих соединений по границам зерен в виде иглообразных хфупких включений снижает механические свойства ванадия.
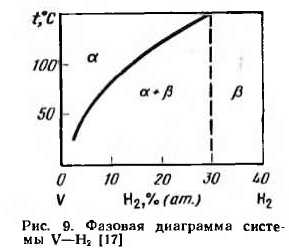
Водороде ванадием образуют твердый раствор внедрения и два гидрида — V2H и VH. На рис. 9 [17] показана фазовая диаграмма состояния системы V—Н2. Как видно на этой диаграмме, растворимость водорода в ванадии с понижением темпертуры резко уменьшается и при комнатной температуре не превышает 2% (ат.), или 1%) (по массе).
В области от 2 до 30% (ат.) сосуществуют две фазы а-[-0. Фаза 0 близка по составу к гидриду V2H и имеет объемноцентрированную гексагональную решетку. Установлено также существование гидрида ванадия VH, отвечающего содержанию водорода 1,2—2% (по массе), или 38,7—50% (ат.).
Ванадий обладает высокой адсорбцией водорода. Так, при комнатной температуре и давлении 1013 Па максимально абсорбция составляет 218 см3 водорода на 1 г ванадия. Поглощение водорода ванадием [7] пропорционально квадратному корню из величины давления водорода и увеличивается с понижением температуры. Гидриды ванадия, выделяясь по границам зерен в виде игольчатых включений, вызывают охрупчивание ванадия, поэтому водород является наиболее вредной примесью в ванадии. Однако гидрид ванадия диссоциирует с выделением водорода при нагреве до 900° С.
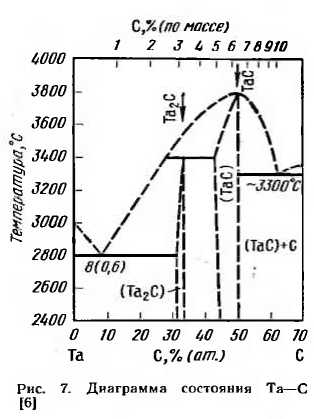
Углерод при взаимодействии с ванадием образует карбиды VC и V2C и твердый раствор внедрения. Характер взаимодействия ниобия с углеродом показан на диаграмме состояния (рис. 10). Растворимость углерода в ванадии при 1000°С составляет 1% (ат.), или 0,2% (по массе), при комнатной температуре эта растворимость не превышает 0,5% (ат.), или 0,1% (п0 мас" се). Непосредственно в равновесии с твердым раствором а находится карбид V2C [33% (ат.)], имеющий гексагональную решетку с периодами: а=0,29 нм, с= =0,46 нм, с[а=1,576.

При содержании углерода выше 0,3% (по массе) в сплавах образуется эвтектика (a+VsC), содержащая 3,5% (по массе) С; ее температура плавления 1650° С. Появление по границам зерен эвтектики и прослоек хрупкого карбида V2C нарушает межзеренную связь и способствует резкому снижению пластичности ванадия.


