Взаимодействие примесей внедрения с тугоплавкими металлами
Взаимодействие примесей внедрения с тугоплавкими металлами
Взаимодействие с ниобием
Кислород с ниобием образует твердый раствор внедрения и ряд окислов: NbO, NbO2 и Nb2O5. Низшие окислы NbO и NbO2 образуются при температурах ниже 400° С, a Nb2O5 — не ниже 400° С. Моноокись NbO имеет кубическую гранецентрированную решетку с периодом а=0,42 нм, а двуокись NbO2 обладает структурой рутила с периодами: а=0,48 нм и с=0,30 нм.
Пятиокись Nb2Os существует в трех модификациях: низкотемпературная а, устойчивая при температуре ниже 900° С, среднетемпературная М, существующая в интервале температур 1000—1100° С, и высокотемпературная модификация Я, устойчивая при температуре не ниже 1100° С. Низкотемпературная модификация имеет две разновидности: аир. Фаза а метастабильная и существует ниже 900° С, причем превращение а-»-р начинается при 600—700° С, но скорость этого превращения очень мала (1000—5000 ч). При 900° С превращение а->-р значительно интенсифицируется и заканчивается за 30 мин.
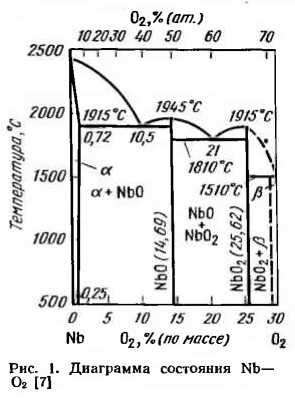
Растворимость кислорода в ниобии при 1915° С согласно диаграмме состояния системы, приведенной на рис. 1 [7], составляет 0,72% (по массе), при 500° С — 0,25% (по массе); при комнатной температуре она не превышает 0,1% (по массе). Такое резкое изменение растворимости кислорода в ниобии с понижением температуры связано со сжатием кристаллической решетки и уменьшением межатомных пустот, в которых размещаются атомы кислорода при образовании раствора внедрения. В результате распада твердого раствора кислород, диффундируя к границам зерен, взаимодействует с ниобием с образованием окисных включений.
При содержании кислорода более 0,72% (по массе) образуется эвтектика Nb — NbO, которая располагается по границам зерен. Образование окислов и эвтектики по границам зерен приводит к нарушению межзеренной связи и к снижению пластичности ниобия.
В заключение необходимо отметить, что при проведении различных пирометаллургических операций (восстановления и спекания порошков, горячей обработки штабиков и др.) при недостаточно хорошем вакууме и при плохой герметичности системы, а также в нейтральных1 неочищенных и неосу-шенных газовых средах всегда происходит некоторое окисление поверхности ниобия. При нагреве ниобий заметно окисляется начиная со 150—200° С; с повышением температуры окисляемость сильно возрастает.
На рис. 2, по данным работы [8], показано увеличение массы образцов ниобия в зависимости от времени при различных температурах.
Различная скорость окисления при высоких температурах обусловлена не только изменением скорости диффузии газов в металле с повышением температуры, но и качественными изменениями, происходящими в структуре окисной пленки. Подробно эти вопросы рассмотрены в работе [8].

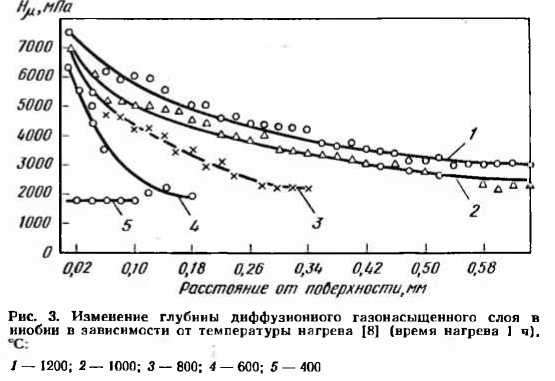
Ввиду низких защитных свойств образующейся окисной пленки при большем содержании кислорода в атмосфере одновременно с окислением происходит диффузия кислорода в металл, сопровождающаяся образованием хрупкого газонасыщенного слоя, глубина которого зависит от температуры нагрева (рис. 3).

Образование окисных пленок и газонасыщенного слоя приводит к снижению пластичности и коррозионной стойкости ниобия, а также способствует возникновению трещин при обработке давлением (ковке, штамповке, прокатке и др.). Поэтому при рассмотрении взаимодействия кислорода с ниобием нужно учитывать не только физико-химические процессы, Происходящие 6 основном металле, но и процессы, происходящие на его поверхности.
Азот с ниобием, как и кислород, образует твердый раствор внедрения и ряд нитридных фаз. На рис. 4, по данным работы [9], приведена схема диаграммы состояния Nb — N2. Фаза является твердым раствором азота в ниобии. Находящаяся в ней в равновесии 0-фаза соответствует соединению Nb2N с плотноупакованной гексагональной решеткой с периодами: а=0,30 нм, с= = 0,56 нм, с/а = 1,85. По данным работы [10] растворимость азота в ниобии при температурах 300, 600, 800, 950 и 1100° С составляет 0,005; 0,019; 0,03; 0,04; 0,05% (по массе) соответственно.
В работе [11] определен коэффициент диффузии азота в ниобии при 500—600° С с образованием твердого раствора.
В той же работе коэффициент диффузии азота в ниобии, дающей Nb2N при 600—900° С, определяется следующим равенством.
При температурах ниже 1000° С образуется смесь нитридов Nb2N и NbN, а выше 1000° С — только NbN [7, с. 145].
Установлено также существование более сложных соединений ниобия типа оксинитридов, которые получаются при взаимодействии нитридов ниобия с окислами при температуре ~750°С. Известны два оксинитрида, отвечающие формулам NbNi^eOo^s и Nbo,82N0,8i00,i9-Оба соединения устойчивы только при температурах, не превышающих 900° С. Включения нитридов имеют характерную иглообразную форму. Хрупкие нитридные фазы по границам зерен резко снижают пластичность ниобия и его способность к пластической деформации.
Водород, как и другие газы, растворяется в ниобии, образуя с ним твердый раствор внедрения. Растворимость водорода в ниобии при комнатной температуре составляет 9,89% (ат.), или 0,9% (по массе). Одновременно с растворением водорода образуются гидриды. Установлено, что ниобий с водородом при 500° С и ниже образует гидрид NbH. По данным работы [6], гидрид ниобия имеет орторомбическую решетку с периодами: а=0,48 нм, 6 = 0,49 нм, с=0,35 нм.
Гидрид ниобия располагается в виде хрупких игольчатых включений по границам зерен a-твердого раствора и является наиболее вредной примесью, так как придает металлу хрупкость. При нагреве до 1000—1200° С в вакууме гидрид разлагается с образованием водорода.
Необходимо также отметить, что ниобий обладает геттерными свойствами и может адсорбировать на своей поверхности большое количество водорода и других газов. Количество удерживаемого ниобием водорода зависит от температуры и давления. Некоторые данные растворимости водорода в ниобии при атмосферном давлении приведены ниже:
Как следует из этих данных, с повышением температуры растворимость водорода в ниобии уменьшается и при нагреве до 900° С становится меньше в 25 раз, чем при комнатной температуре. Поскольку в основе растворения и удаления газов из металла лежат диффузионные процессы, то следует считать, что водород обладает значительной скоростью диффузии.
Условия диффузии водорода в ниобии подробно исследовались в работе [11]. Установлено, что коэффициент диффузии водорода в ниобии определяется равенством.
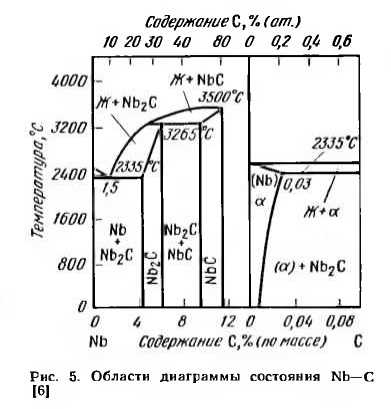
Углерод с ниобием образует твердый раствор внедрения и ряд карбидных фаз. На рис. 5 приведена часть диаграммы состояния в области сплавов, богатых ниобием. Растворимость углерода в ниобии при эвтектической температуре 2335° С составляет 0,03% (по массе), или 0,2% (ат). С понижением температуры растворимость углерода в ниобии заметно уменьшается и при комнатной температуре составляет менее 0,01 % (по массе).
В ниобии, содержащем углерода до 0,03% (по массе), при распаде твердого раствора а выделяется карбид Nb2C, образующий тончайшую хрупкую сетку по границам зерен. При содержании углерода, превышающим предел растворимости (0,03% С), по границам зерен возникает прослойка эвтектики a-|-Nb2C. Образование карбидной сетки и эвтектических прослоек сопровождается нарушением межзеренной связи и резким снижением способности ниобия к пластической деформации. Поэтому углерод в чистом ниобии является весьма вредной примесью, его содержание должно быть меньше 0,01 % (по массе).
|
Температура, °C . |
. 20 |
200 |
300 |
350 |
400 |
450 |
|
Растворимость, см3/г . |
. 104 |
93,3 |
88,0 |
83,6 |
76,8 |
65,6 |
|
Температура, °C . . |
. 500 |
550 |
650 |
700 |
800 |
900 |
|
Растворимость, см3/г . |
. 74,4 |
29,7 |
18,5 |
9,7 |
6,1 |
4,0 |
Однако в некоторых сплавах ниобия, особенно содержащих более активные, чем ниобий карбидсодержащие добавки (Zr, Ti, Hf), содержание углерода без заметного снижения пластичности может быть повышено до 0,08—0,1% (по массе).
Это объясняется тем, что при распаде раствора образуются карбиды ZrC, TiC, HfC, которые располагаются внутри зерен и по их границам в виде высокодисперсных разрозненных включений. Обладая высокой прочностью и твердостью, они способствуют упрочнению металла. Карбидное упрочнение является одним из основных методов упрочнения современных ниобиевых сплавов.